2022年3月�, 明德生物4款A(yù)類產(chǎn)品首次通過歐盟IVDR注冊�����。" />
完结小说排行榜,有声小说下载
喜訊���!明德生物再獲IVDR注冊�����!
發(fā)布時間:2022-06-30
2022年3月, 明德生物4款A(yù)類產(chǎn)品首次通過歐盟IVDR注冊���。
僅3個月后�,明德生物自主研發(fā)的五款儀器: 實時熒光PCR分析儀(Real-Time PCR System-QPT1000,QPT1000-2,QPT1000-4)�、干式熒光免疫分析儀(Fluorescence Immunity Analyzer-QFT9000)、血氣分析儀(Blood Gas Analyzer-PT1000)�����,全自動化學(xué)發(fā)光免疫分析儀(Chemiluminescence Immunoassay Analyzer-CF10)和全自動化學(xué)發(fā)光免疫分析儀(Chemiluminescence Immunoassay Analyzer-CP800)于2022年6月21日成功完成IVDR Class A注冊,再獲歐盟市場準(zhǔn)入資格�。
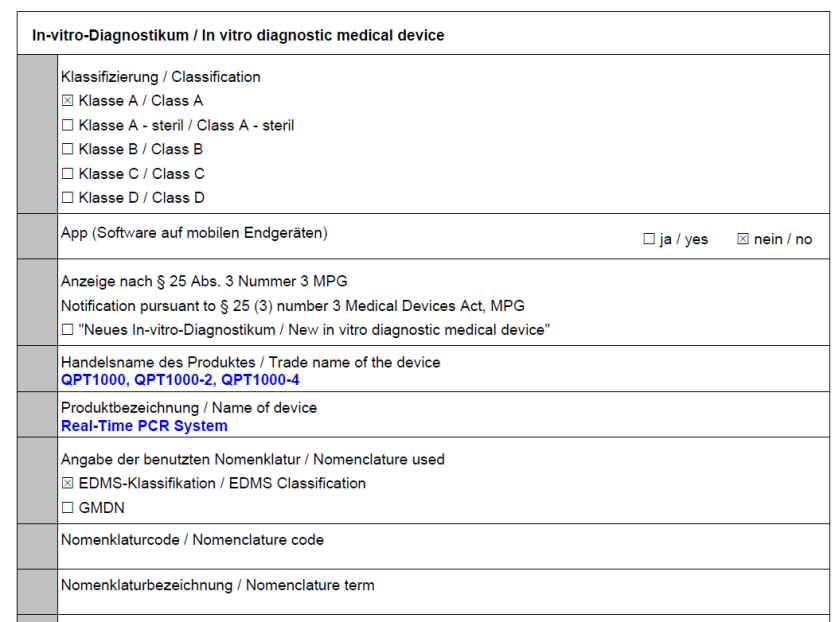
對于A類產(chǎn)品來說,通過IVDR注冊是進(jìn)入歐盟市場的必要條件����。2017年4月5日歐盟正式簽發(fā)的新版體外診斷醫(yī)療器械法規(guī)IVDR(EU 2017/746),相對于舊指令�,新法規(guī)無論從上市前申請或上市后監(jiān)督都進(jìn)行了大規(guī)模的修訂,內(nèi)容更全面系統(tǒng)�����。隨著 UDI 的實施和 EUDAMED 數(shù)據(jù)庫的建立��,新 IVDR 法規(guī)下上市的產(chǎn)品將實現(xiàn)全球多方全生命周期的監(jiān)管�����,實現(xiàn)產(chǎn)品動態(tài)實時追蹤的可能����。這也標(biāo)志著歐盟當(dāng)局對醫(yī)療設(shè)備領(lǐng)域監(jiān)管的進(jìn)一步重視,同時也預(yù)示著在歐盟各成員國內(nèi)醫(yī)療器械監(jiān)管的尺度將得到進(jìn)一步的統(tǒng)一�。
明德生物的實時熒光PCR分析儀、干式熒光免疫分析儀�����、血氣分析儀等A類產(chǎn)品獲得IVDR 注冊,不僅是明德生物重視全球醫(yī)療器械體外診斷市場���,快速響應(yīng)世界各國醫(yī)療器械相關(guān)法律法規(guī)要求的體現(xiàn)�,更是明德生物產(chǎn)品緊貼市場需求的體現(xiàn)�����。在歐盟法規(guī)在由IVDD CE向IVDR CE過渡之際�,明德生物能夠及時滿足新法規(guī)嚴(yán)苛的要求,確保優(yōu)質(zhì)的產(chǎn)品繼續(xù)服務(wù)于市場��,并肩負(fù)“讓每個人享受健康的美好”的使命���,全方位提升實驗室質(zhì)量和效率,同時為檢驗質(zhì)量管理保駕護(hù)航���,提高臨床及病患滿意度��,為醫(yī)生和患者帶來更好的診療體驗���。




 鄂公網(wǎng)安備 42011502000634
鄂公網(wǎng)安備 42011502000634